Hóa học đại cương/Nguyên tử/Cấu tạo nguyên tử
Nguyên tử được tạo ra từ các Hạt mang điện nhỏ nhứt không thể phân chia nhỏ hơn được gọi là Điện tử .
Điện tử
sửaĐiện tử là các Hạt mang điện nhỏ nhứt không thể phân chia nhỏ hơn được . Có tất cả 3 loại điện tử đả được tìm thấy đó là Điện tử âm , Điện tử dương và Điện tử trung hòa . Tính chất của 3 loại điện tử này được liệt kê trong bảng tính chất bên dưới
Điện tử Ký hiệu Điện mang Khối lượng Điện tử âm Điện tử dương Điện tử trung hòa
Mô hình nguyên tử Rutherford
sửaErnest Rutherford (1871-1937) đã dùng một chùm hạt alpha bắn phá một lá vàng mỏng trong thí nghiệm mang tên ông. Hạt alpha là một hạt mang điện dương (+2), có khối lượng khoảng bốn lần khối lượng nguyên tố hydrogen. Kết quả thu được cho thấy hầu hết các hạt alpha đi qua lá vàng mà không bị lệch hướng, một số hạt (1/8000 so với số hạt đi thẳng) bị lệch hướng và một số ít hạt bị bật ngược trở lại. Kết quả này cho phép kết luận rằng nguyên tử có cấu tạo rỗng, các Điện tử âm bao quanh một hạt có kích thước rất nhỏ so với kích thước nguyên tố . Trên lá kim loại các phân tử mang điện tích dương phân bố rất thưa thớt vì thế các hạt alpha đi qua lá kim loại dễ dàng. Một số hạt đi gần với các hạt điện tích dương và các hạt này tích điện lớn nên đẩy hạt alpha đi lệch hướng ban đầu hoặc ngược hướng ban đầu. Ông gọi đó là hạt nhân. Hạt nhân có các điện tử quay xung quanh giống như các hành tinh quay xung quanh Mặt Trời, tuy thể tích hạt nhân rất nhỏ so với nguyên tố nhưng phần lớn khối lượng nguyên tố lại tập trung ở trong Hạt nhân. Mô hình này còn có cái tên là mẫu hành tinh nguyên tử.
Vào năm, Rutherford công bố mô hình nguyên tử được gọi là Mô hình nguyên tử Rutherford
- Nguyên tử có các vòng tròn quỹ đạo chứa nguyên tử điện âm được gọi là Điện tử âm quay quanh một Hạt nhân ở trong tâm chứa các nguyên tử điện dương được gọi là Điện tử dương và nguyên tử điện trung hòa được gọi là Điện tử trung hòa
- Ở trạng thái cân bằng, tổng điện của nguyên tử bằng không
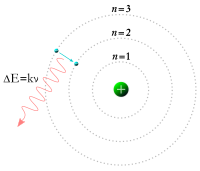
Mô hình nguyên tử Bohr
sửaNăm 1913, nhà vật lý lý thuyết người Đan Mạch Niels Bohr (1885-1962) đưa ra Mô hình nguyên tử Bohr .
Các mức năng lượng nghỉ giống như các bậc thang, điện tử không thể ở giữa các mức đó được mà chỉ có thể ở trên một bậc thang nào đó. Khi chuyển từ mức năng lượng này sang mức năng lượng khác, điện tử có thể hấp thụ hoặc phát ra năng lượng. Năng lượng hấp thụ và phát xạ của một quang tử chính bằng sự sai khác năng lượng giữa các quỹ đạo.
- Các điện tử chuyển động xung quanh hạt nhân theo các quỹ đạo vòng tròn có năng lượng lượng tử và bán kính cố định.
- Năng lượng của điện tử phụ thuộc vào bán kính quỹ đạo của điện tử .
- Điện tử nằm trên quỹ đạo có bán kính lớn nhất sẽ có năng lượng nghỉ nhỏ nhất và năng lượng động cao nhứt .
- Năng lượng ở mức năng lượng ổn định hay ở trạng thái ổn định .
- Nếu Nguyên tử hấp thụ năng lượng của một Lực (Điện , Ánh sáng ...) năng lượng của NguyêN tử sẻ thay đổi lúc này điện tử nằm ở trạng thái kích thích.
Không giải thích được
sửaMô hình Rutherford không thể giải thích được tại sao điện tử lại có thể ổn định trong nguyên tử mà không bị rơi vào hạt nhân